Методы анализа некоторых противогрибковых препаратов |
|
Кислота борная (а cidum boricum ) противогрибковый лекарственный микоз клотримазол НзВОз Описание. Бесцветные, блестящие, жирные на ощупь чешуйки или мелкокристаллический порошок без запаха.[1] Получение. Для медицинских целей борную кислоту получают из буры обработкой горячего раствора ее минеральной кислотой:
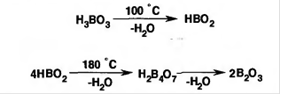
Подлинность. Кислота борная возгоняется с парами воды и этанола. При нагревании кристаллов она постепенно теряет воду, образует вначале (при 100°С) метаборную кислоту, затем стекловидную сплавленную массу (тетраборная кислота), которая при последующем прокаливании теряет воду, оставляя остаток оксида бора (III):[1]
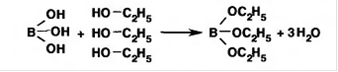
Подлинность соединений бора можно установить по реакции образования в присутствии этанола борноэтилового эфира:
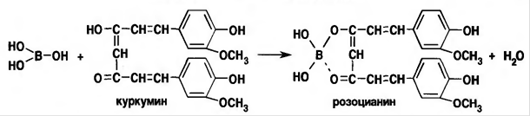
Если затем смесь поджечь, она горит пламенем, окаймленным зеленым цветом. Соединения бора идентифицируют с помощью куркумовой бумаги, которая от смачивания раствором кислоты борной (буры) и хлороводородной кислоты окрашивается при высушивании в розовый или буровато-красный цвет, переходящий после обработки раствором аммиака в зеленовато-черный. Установлено, что содержащееся в куркуме производное ацетилацетона - куркумин (диферулоилметан) в енольной форме взаимодействует с кислотой борной, образуя розоцианин - внутрикомплексное окрашенное соединение по типу эфира:[1]
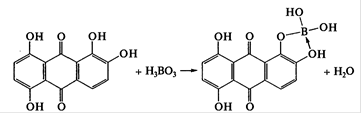
В качестве реактивов для капельного обнаружения кислоты борной могут быть использованы раствор кармина в концентрированной серной кислоте (фиолетовое окрашивание), раствор хинализарина в концентрированной серной кислоте (синее окрашивание), раствор ализаринового красного С в концентрированной серной кислоте (красное окрашивание), водный раствор пирокатехинового фиолетового в присутствии аммиачного буферного раствора (красное окрашивание).[1] Хинализарин реагирует с борной кислотой в присутствии концентрированной серной кислоты с образованием продуктов синего цвета:
Испытания на чистоту. Соли кальция, железа, тяжелых металлов, мышьяка, сульфатов, определение которых осуществляют с использованием соответствующих эталонных растворов. Количественное определение: используют кислотные свойства растворов кислоты борной в глицерине и щелочные свойства водных растворов натрия тетрабората. При прямом титровании кислоты борной щелочью образуется метаборат натрия, который в водных растворах сильно гидролизуется:[1]
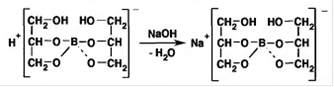
В результате гидролиза щелочная реакция наступает до точки эквивалентности. Поэтому для количественного определения используют способность кислоты борной образовывать с глицерином сильную одноосновную диглицериноборную кислоту, которую можно с достаточной точностью оттитровать щелочью, используя в качестве индикатора фенолфталеин:
Количественное определение кислоты борной проводят в смеси свежепрокипяченной воды (свободной от углекислого газа) и нейтрализованного (по фенолфталеину) глицерина при комнатной температуре. Для контроля полноты образования натриевой соли диглицериноборной кислоты к концу титрования добавляют дополнительную порцию глицерина. Сохранение при этом розовой окраски свидетельствует о достижении эквивалентной точки. Если окраска исчезает, вновь добавляют глицерин и титрование продолжают. Добавление глицерина продолжают до тех пор, пока розовая окраска не перестанет исчезать.[1] Йод ( iodum ) и раствор йода спиртовой 5% ( solutio iodi spirituosa ) Описание. Серовато-черные с металлическим блеском пластинки или сростки кристаллов с характерным запахом.[1] Прозрачная жидкость красно-бурого цвета с характерным запахом. Свойства. Йод летуч при обычной температуре, при нагревании возгоняется, образуя фиолетовые пары. Т. пл. 113-114°С. Растворимость. Йод очень мало растворим в воде, растворим в органических растворителях (эфире, хлороформе). В водных растворах йодидов йод растворяется с образованием комплексной соли (полийодида): Kl + I 2 -> К[ I 3 ] Получение. Йод (слово «йодос» − фиолетовый) был впервые обнаружен в 1811 г. Французским фармацевтом Куртуа в золе морских водорослей. Природные минералы йода − лаутарит и йодаргирит встречаются редко. Источники промышленного получения йода - подземные воды нефтяных и газовых месторождений, отходы при получении чилийской селитры и морские водоросли. Поскольку содержание йода в природных источниках очень мало, основной задачей при его получении является концентрирование элемента.[5] |